De acuerdo a las unidades que no acreditaste en el periodo normal, comparto los archivos de las actividades a realizar como parte de las asesorías complementarias.
Ejercicios asesorías complementarias Unidad I
Ejercicios asesorías complementarias Unidad II
Ejercicios asesorías complementarias Unidad III
El módulo Análisis de la materia y energía se imparte en el segundo y tercer semestre y corresponde al núcleo de formación básica de todas las carreras de Profesional Técnico y Profesional Técnico-Bachiller. Tiene como finalidad que el alumno interprete el comportamiento de la materia y la energía a través del análisis de sus propiedades y de sus compuestos con el enfoque ciencia-tecnología-sociedad.
martes, 13 de diciembre de 2016
lunes, 12 de diciembre de 2016
EJERCICIOS DE RECUPERACIÓN
Revisa por favor tu avance individual. Verifica los porcentajes que alcanzaste de cada unidad. Si tu porcentaje por unida es menor al 70%, entonces realiza las actividades siguientes:
Ejercicios de recuperación Unidad I y Unidad III
Para la unidad I realiza los ejercicios de las páginas 27-35, 44-47 y 53-59.
Para la unidad III realiza los ejercicios de las páginas 65, 74-75
Ejercicios de recuperación Unidad II
Realiza los ejercicios del 11.5 al 11.14 y del 11.21 al 11.24
miércoles, 2 de noviembre de 2016
2.1 Realiza el balance de masas de reacciones químicas inorgánicas aplicando los cálculos estequiométricos
A. Descripción de las leyes ponderales
Un primer aspecto del conocimiento químico fue conocer la relación entre las cantidades de los cuerpos que intervienen en una reacción pasando de lo meramente cualitativo a lo cuantitativo. El descubrimiento de la balanza y su aplicación sistemática al estudio de las transformaciones químicas por LAVOISIER dio lugar al descubrimiento de las leyes de las combinaciones químicas y al establecimiento de la química como ciencia.
ACTIVIDAD
Un primer aspecto del conocimiento químico fue conocer la relación entre las cantidades de los cuerpos que intervienen en una reacción pasando de lo meramente cualitativo a lo cuantitativo. El descubrimiento de la balanza y su aplicación sistemática al estudio de las transformaciones químicas por LAVOISIER dio lugar al descubrimiento de las leyes de las combinaciones químicas y al establecimiento de la química como ciencia.
ACTIVIDAD
Realiza un mapa conceptual sobre las leyes ponderales. Te recomiendo obtengas mas información de la que proporciona el vídeo para que este completo tu mapa.
lunes, 10 de octubre de 2016
1.2.2. BALANCEO DE ECUACIONES QUÍMICAS
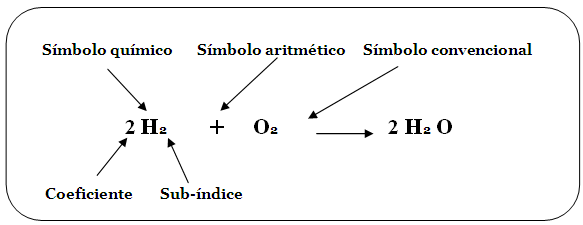
Te habrás dado cuenta de que en muchas ecuaciones de reacciones químicas que hemos revisado, había números ubicados antes de los símbolos o las formulas, por ejemplo:
Hemos comentado que que en las ecuaciones químicas se debe representar el cumplimiento de la ley de conservación de la materia y la forma de hacerlo es mostrando que la cantidad de átomos que forman los reactivos es la misma que los productos.
¿Qué se puede hacer para representar lo anterior?
BALANCEO POR TANTEO
BALANCE POR MÉTODO ALGEBRAICO
ACTIVIDAD
Balanceo de ecuaciones 1
Balanceo de ecuaciones 2
Balanceo de ecuaciones 3
Balanceo de ecuaciones 4
Balanceo de ecuaciones 5
miércoles, 21 de septiembre de 2016
1.2.1 NOMENCLATURA DE QUÍMICA INORGÁNICA
EL LENGUAJE DE LA QUIMICA, SU NOMENCLATURA
Se calcula que en la actualidad se han identificado alrededor de 25 millones de compuestos químicos "mas los que se acumule". Cada uno de esos compuestos tiene un nombre, una fórmula y una estructura específicos, gracias a que se ha diseñado un método para sistematizarlos, nombrarlos y ordenarlos, La Nomenclatura.
Recuerda además que, como te mencionamos en el aula, los elementos químicos pueden formar infinidad de compuestos al enlazarse unos con otros.
La nomenclatura actual considera lo siguiente:
- La mayoría de los átomos tienen la propiedad de unirse químicamente formando un enlace
- La capacidad de los átomos de un elemento para reaccionar con los de otro elemento está determinada por sus electrones de valencia.
- La valencia y el numero de oxidación de cada elemento proporcionan información sobre la manera en que se enlazan los átomos
- Los compuesto se consideran eléctricamente neutros
Visita el siguiente enlace para que conozcas este lenguaje y realiza los ejercicios propuestos.
Además por si no te queda claro:
Nomenclatura Sistemática, Stock y Tradicional
lunes, 5 de septiembre de 2016
G. ENLACES QUÍMICOS
AMAE
OBJETIVO.- Identificar los tipos de enlace en la formación de moléculas relacionándolos con sus propiedades y las fuerzas que las unen.
Revisa el siguiente documento y realiza las actividades propuestas.
Además están estos vídeos por si quedaron dudas.
F. CONFIGURACIÓN ELECTRÓNICA II
AMAE
LA TABLA CUÁNTICA
En esta tabla es posible consultar el último nivel
de energía de la configuración electrónica de cada elemento, si como sus
números cuánticos (ver configuración electrónica en este blog). Así mismo nos permite realizar la configuración electrónica de manera mas sencilla.
En la casilla de cada elemento se muestra el símbolo, el número
atómico (abajo a la izquierda) y el valor de la masa atómica (arriba del símbolo).
Los bloques s, p, d y f están señalados en la última fila de
la tabla
En el ángulo superior izquierdo se encuentran los números cuánticos:
- · n con valores de 1 hasta 7. Los valores correspondientes aparecen en la última columna del extremo derecho de la tabla.
- · l con valores de 0 para s; 1 para p; 2 para d y 3 para f
- · m con valores de 0 para l=0. Para l iguales o mayores que 1, los valores van de -l a +l pasando por cero. Por ejemplo, para l=2, los valores de me son -2, -1, 0, +1, +2
- · s con valores de +1/2 y -1/2.
Observa la configuración electrónica del calcio y del escandio:
Ca20: 1s2
2s2 2p6 3s2 3p6 4s2
Sc21: 1s2
2s2 2p6 3s2 3p6 4s2 3d1
¿Cómo obtener la configuración utilizando la tabla cuántica?
Utiliza el siguiente enlace para enterarte como usarla
ACTIVIDAD
Realiza una presentación en PowerPoint o un vídeo en el que expliques como se realiza la configuración electrónica utilizando la tabla cuántica. Explica uno de los siguientes elementos P, Fe, Xe, Pt, As, Pd o Eu.
Envía tu presentación o vídeo al correo electrónico que les proporcione en clase.
E. CONFIGURACIÓN ELECTRÓNICA
AMAE
Antes de que continúes leyendo sobre la configuración electrónica, hay que conocer los números cuánticos
Números Cuánticos
La distribución de los electrones en diferentes orbitales atómicos
se conoce como configuración electrónica.
Los átomos con números atómicos menores que 20 tienen
configuraciones electrónicas más sencillas.
Los átomos con muchos protones tienen mayor dificultad para
retener a sus electrones más alejados del núcleo. Por esta razón, el tamaño del
átomo es mayor y la distribución de electrones en sus orbitales, es decir, su configuración
electrónica, es más compleja.
El orden en que los electrones ocupan los orbitales, es
decir, su configuración electrónica, está regido por tres reglas:
- Los electrones ocupan orbitales en orden creciente de energía, es decir, primero se llenan los orbitales de menor energía y después los orbitales con más energía. Este es el principio de Aufbau.
- Un orbital puede ser ocupado solo por dos electrones con spin de signo contrario. Este es el principio de exclusión de Pauli.
- Cuando varios electrones ocupan sus diferentes orbitales pero con más de un subnivel de energético l, los electrones ocupan sus diferentes orbitales pero con diferente spin. Por ejemplo, en el caso de los orbitales p se van ocupando los x, y, y z con un solo electrón y después, si hay más electrones, se aparean. Esta es la regla de Hund.
Observa la siguiente figura en ella se representan todos los
posibles orbitales que puede tener un átomo.
Los electrones, como ves, comienzan por llenar el nivel mas bajo
de energía, el más estable: el 1s. Al aumentar el nivel de energía, se ocupa el
siguiente orbital el 2s, 2p, 3s y si sucesivamente.
Para describir la configuración electrónica de un átomo, al símbolo del elemento se agrega la notación de los orbitales y un exponente que señale el numero de electrones en cada orbital.
El helio tiene un numero atómico de Z de 2. Posee dos electrones y por tanto, solo ocupa el orbital 1s. Su configuración electrónica se escribe:
He: 1s2
El lito tiene tres electrones. Su tercer electrón ya ocupa el
siguiente nivel de energía, el orbital 2s. Su configuración electrónica es:
Li: 1s2 2s1
La configuración electrónica de un elemento es igual que la del
elemento anterior, pero el último electrón
ocupa un lugar diferente. Hay excepciones, pero el orden de los
elementos según su número atómico permite encorar estas particularidades de la
configuración electrónica.
Por ejemplo, para escribir la configuración electrónica de Ca20,
observa la tabla de llenado de niveles y subniveles, y sabiendo que su número atómico
es 20 su notación quedaría así:
Ca: 1s2 2s2 2p6 3s2 3p6
4s2
Capacidad máxima en cada tipo de orbital
s
|
1 orbital
|
2
electrones
|
p
|
3
orbitales
|
6
electrones (dos en cada uno)
|
d
|
5
orbitales
|
10
electrones (dos en cada uno)
|
f
|
7 orbitales
|
14
electrones (dos en cada uno)
|
ACTIVIDAD
Escribe en tu cuaderno la configuración electrónica de los siguientes elementos: K, N, Al, Sn, I, Ba, Mn, Cl, Au
Apóyate para este ejercicio del siguiente vídeo.
Y como evidencia en una hoja para entregar:
- Realiza la configuración electrónica de los siguientes elementos: Na, Rb, Cl, Mo, Br, P y Xe.
- Investiga lo siguiente:
- ¿Por qué la configuración electrónica tiene una relación directa con las propiedades químicas de los átomos de un elemento?
- ¿Qué son los electrones de valencia?
- ¿Qué relación hay entre los electrones de valencia y las características del elemento?
D. CLASIFICACIÓN DE LOS ELEMENTOS
Durante el siglo XIX se realizaron varios intentos para clasificar a los elementos descubiertos hasta entonces, aproximadamente 40.
Entre los primeros intentos de clasificación están las Tríadas de Döbereiner y las Octavas de Newlands. Sin embargo, la clasificación que dio origen a la tabla periódica actual se debe a dos científicos: Lothar Meyer y Dimitre I. Mendeléiev.
Cada uno por su cuenta, sin saber que alguien mas estaba trabajando con el mismo propósito, se dedico a reunir la información existente sobre los elementos y a encontrar la manera de relacionar las masas atómicas con las propiedades de los elementos. La tabla de Mendeléiev se publico un años antes que la de Meyer.
ACTIVIDADES
- ¿Cuáles fueron los criterios de la clasificación de los elementos realizados por Döbereiner y Newlands?
- Lleno los huecos de la siguiente tabla.
domingo, 28 de agosto de 2016
C. LOS MODELOS ATÓMICOS
Si bien hubo muchos modelos para explicar la estructura del átomo, es muy importante considerar la época en que se propusieron. la disponibilidad de conocimientos y de instrumentos de investigación y medición no es como la que existe en la actualidad.
La acumulación de conocimientos y el diseño de mejores instrumentales y materiales para hacer sus representaciones juegan un importante papel.
Puedes visitar las siguientes ligas para mayor información:
ACTIVIDADES
Tarea 1
Para Démocrito la materia estaba formada por pequeñas partículas indivisibles llamadas átomos. Investiga las características que atribuyó al átomo hace 2500 años y sus argumentos.
Tarea 2
Elije un modelo atómico de los mencionados en el vídeo e investiga un poco mas sobre el.
Tarea 3
Prepara una presentación de tu modelo por escrito, máxima una cuartilla. Considera que la presentación se la expondrás a un niño de entre 6 y 7 años, por lo que tu exposición deberá ser lo mas clara y simple posible.
Tarea 4
Compara los modelos atómicos de Dalton, Thomson, Rutherford, Bohr y Schrodinger. Registra diferencias y semejanza entre ellos (realiza un cuadro compartativo).

B. PROPIEDADES DE LA MATERIA
El ojeto de estudio de la química es la materia y sus transformaciones. Algunos cambios dependen de factores externos, como el movimiento, la temperatura y la posición. Otros afectan la naturaleza de la materia de manera que pueden convertirla en una diferente.
El humano, mediante el conocimiento científico, ha incidido en las trasformaciones que la materia ha experimentado y ha generado un cambio en su medio.
La materia y sus propiedades
Cambios químicos y físicos
ACTIVIDADES
- ¿Cómo defines la materia?
- ¿Qué propiedades o atributos caracterizan a la materia que te rodea?
- Realiza un mapa conceptual sobre la materia.
- Investiga cuáles son los procedimientos físicos y químicos más comunes en el laboratorio y la industria para separar mezclas.
- Crea un superheroe o supervillano. Justifica los poderes de tu personaje empleando los temas que se vieron en esta sección.
lunes, 15 de agosto de 2016
A. Determinación de la importancia de la Química como ciencia
Una de las particularidades del ser humano es su capacidad para transformar su medio con el objeto de vivir mejor. En la actualidad prácticamente todo tienen que ver con la química: la mayor parte de las actividades industriales, los productos que consumimos a diario, como el jabón, el yogur, el queso, los detergentes, los desinfectantes, el abono, las computadoras, las telas teñidas y las servilletas. La lista sería interminable gracias a los avances de la química.
¿Consideras necesario estudiar la química? La respuesta lo descubrirás a medida en que la avances en este curso.
La química en la vida diaria
¿Cómo sería vivir sin química?
ACTIVIDAD
- Elabora una lista de los artículos que utilizas en un día normal e indica las ciencias que según tu parecer intervinieron en la elaboración de cada material.
- ¿Qué es para ti la química?
- Retoma la lista anterior y analiza qué papel tienen la química en tu vida
- ¿Consideras que la química es benéfica o perjudicial en tu vida? ¿Por qué?
- Describe en una cuartilla la importancia de la química y el cómo seria vivir sin ella.
DOCUMENTOS QUE UTILIZAREMOS EN ESTE CURSO
Da clic en los enlaces para poder ingresar y descargar los documentos que deberán tener en tu carpeta de evidencia.
Les recuerdo que deben firmarlo ustedes y sus papas o tutores.
¿EXCELENCIA SIGNIFICA?
Comparto con ustedes un vídeo de 5 minutos de Miguel Ángel Cornejo. Un personaje del que he aprendido mucho.
B I E N V E N I D O S
El blog tiene la finalidad de ayudarte a alcanzar las competencias que tienes que desarrollar, a través de actividades especialmente diseñadas para ello.
El módulo está conformado por tres unidades de aprendizaje. En la primera unidad el alumno relaciona el comportamiento de la materia y la energía en función de sus propiedades; en la segunda unidad obtiene podrá realizar el balance de masas y de energía calorífica, y finalmente, en la tercera unidad diferenciará los compuestos del carbono y derivados, de acuerdo a su nomenclatura establecida por la Unión Internacional de Química Pura y Aplicada (IUPAC).
Suscribirse a:
Entradas (Atom)