De acuerdo a las unidades que no acreditaste en el periodo normal, comparto los archivos de las actividades a realizar como parte de las asesorías complementarias.
Ejercicios asesorías complementarias Unidad I
Ejercicios asesorías complementarias Unidad II
Ejercicios asesorías complementarias Unidad III
ANÁLISIS DE LA MATERIA Y ENERGÍA
El módulo Análisis de la materia y energía se imparte en el segundo y tercer semestre y corresponde al núcleo de formación básica de todas las carreras de Profesional Técnico y Profesional Técnico-Bachiller. Tiene como finalidad que el alumno interprete el comportamiento de la materia y la energía a través del análisis de sus propiedades y de sus compuestos con el enfoque ciencia-tecnología-sociedad.
martes, 13 de diciembre de 2016
lunes, 12 de diciembre de 2016
EJERCICIOS DE RECUPERACIÓN
Revisa por favor tu avance individual. Verifica los porcentajes que alcanzaste de cada unidad. Si tu porcentaje por unida es menor al 70%, entonces realiza las actividades siguientes:
Ejercicios de recuperación Unidad I y Unidad III
Para la unidad I realiza los ejercicios de las páginas 27-35, 44-47 y 53-59.
Para la unidad III realiza los ejercicios de las páginas 65, 74-75
Ejercicios de recuperación Unidad II
Realiza los ejercicios del 11.5 al 11.14 y del 11.21 al 11.24
miércoles, 2 de noviembre de 2016
2.1 Realiza el balance de masas de reacciones químicas inorgánicas aplicando los cálculos estequiométricos
A. Descripción de las leyes ponderales
Un primer aspecto del conocimiento químico fue conocer la relación entre las cantidades de los cuerpos que intervienen en una reacción pasando de lo meramente cualitativo a lo cuantitativo. El descubrimiento de la balanza y su aplicación sistemática al estudio de las transformaciones químicas por LAVOISIER dio lugar al descubrimiento de las leyes de las combinaciones químicas y al establecimiento de la química como ciencia.
ACTIVIDAD
Un primer aspecto del conocimiento químico fue conocer la relación entre las cantidades de los cuerpos que intervienen en una reacción pasando de lo meramente cualitativo a lo cuantitativo. El descubrimiento de la balanza y su aplicación sistemática al estudio de las transformaciones químicas por LAVOISIER dio lugar al descubrimiento de las leyes de las combinaciones químicas y al establecimiento de la química como ciencia.
ACTIVIDAD
Realiza un mapa conceptual sobre las leyes ponderales. Te recomiendo obtengas mas información de la que proporciona el vídeo para que este completo tu mapa.
lunes, 10 de octubre de 2016
1.2.2. BALANCEO DE ECUACIONES QUÍMICAS
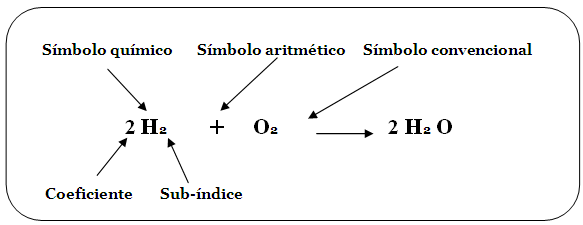
Te habrás dado cuenta de que en muchas ecuaciones de reacciones químicas que hemos revisado, había números ubicados antes de los símbolos o las formulas, por ejemplo:
Hemos comentado que que en las ecuaciones químicas se debe representar el cumplimiento de la ley de conservación de la materia y la forma de hacerlo es mostrando que la cantidad de átomos que forman los reactivos es la misma que los productos.
¿Qué se puede hacer para representar lo anterior?
BALANCEO POR TANTEO
BALANCE POR MÉTODO ALGEBRAICO
ACTIVIDAD
Balanceo de ecuaciones 1
Balanceo de ecuaciones 2
Balanceo de ecuaciones 3
Balanceo de ecuaciones 4
Balanceo de ecuaciones 5
miércoles, 21 de septiembre de 2016
1.2.1 NOMENCLATURA DE QUÍMICA INORGÁNICA
EL LENGUAJE DE LA QUIMICA, SU NOMENCLATURA
Se calcula que en la actualidad se han identificado alrededor de 25 millones de compuestos químicos "mas los que se acumule". Cada uno de esos compuestos tiene un nombre, una fórmula y una estructura específicos, gracias a que se ha diseñado un método para sistematizarlos, nombrarlos y ordenarlos, La Nomenclatura.
Recuerda además que, como te mencionamos en el aula, los elementos químicos pueden formar infinidad de compuestos al enlazarse unos con otros.
La nomenclatura actual considera lo siguiente:
- La mayoría de los átomos tienen la propiedad de unirse químicamente formando un enlace
- La capacidad de los átomos de un elemento para reaccionar con los de otro elemento está determinada por sus electrones de valencia.
- La valencia y el numero de oxidación de cada elemento proporcionan información sobre la manera en que se enlazan los átomos
- Los compuesto se consideran eléctricamente neutros
Visita el siguiente enlace para que conozcas este lenguaje y realiza los ejercicios propuestos.
Además por si no te queda claro:
Nomenclatura Sistemática, Stock y Tradicional
lunes, 5 de septiembre de 2016
G. ENLACES QUÍMICOS
AMAE
OBJETIVO.- Identificar los tipos de enlace en la formación de moléculas relacionándolos con sus propiedades y las fuerzas que las unen.
Revisa el siguiente documento y realiza las actividades propuestas.
Además están estos vídeos por si quedaron dudas.
Suscribirse a:
Comentarios (Atom)